導入
脂質ナノ粒子(LNP)は、mRNA薬物送達のコア技術プラットフォームを表し、細胞膜構造を模倣することにより効率的な核酸輸送を可能にします。 この記事では、LNP組成の専門分析、膜貫通送達の重要なステップ、および基礎となる分子メカニズムを提供します。
I LNPの構成と構造特性
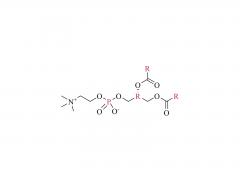
LNPは次のコアコンポーネントで構成されています。
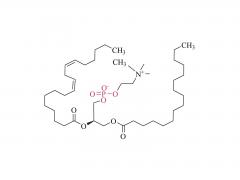
1。カチオン/イオン化可能な脂質(e。g。、SM-102、ALC-0315)
- 機能:静電的相互作用を介して負に帯電したmRNAを結合するために、酸性条件下で正に帯電します。毒性を低下させるための生理学的pHで中性。
- 重要な役割:LNP自己組織化をmRNAをカプセル化するコアシェル構造に駆り立てます。
2。ヘルパー脂質(e。g。、DSPC、コレステロール)
-DSPC(1,2-distearoyl-Sn-glycero-3-ホスホコリン):膜の安定性を高め、標的細胞膜との融合を促進します。
- コレステロール:脂質二重層の流動性を調節し、LNPの血清安定性を改善します。
3。ペギー化脂質(e。g。、dmg-peg2000)
- 機能:立体障害、延長時間を介してLNP凝集を減らし、粒子サイズを調節します(通常60●100 nm)。
ii。 LNP強化mRNAの膜貫通送達プロセス
1。細胞ターゲティングとエンドサイトーシス
- ターゲティングメカニズム:LNPは、受動的ターゲティング(透過性と保持、EPR効果の向上)または活性ターゲティング(リガンド修飾)を介して、標的細胞(例えば、筋肉細胞、免疫細胞)に蓄積します。
-Endocytic経路:LNPは、クラスリンを介したエンドサイトーシスまたはカベオラ依存性の取り込みを介して細胞に入り、初期のエンドソームを形成します。
2。エンドソーム脱出
- pH感受性メカニズム:
- エンドソーム酸性化(pH5。0●6。0)イオン化可能な脂質のプロトン化をトリガーし、LNP構造の再編成を誘導します。
- カチオン性脂質は、エンドソーム膜のアニオン性リン脂質(例えば、ホスファチジルセリン)と相互作用し、「プロトンスポンジ効果」または膜融合を介してmRNAを細胞質に放出して膜を破壊します。
3。mRNAの細胞質放出と翻訳
- 放出メカニズム:脂質膜の崩壊に続いて、mRNAが拡散するか、リボソームにシャペロンされます。
- 翻訳の開始:自由mRNAは、真核生物翻訳開始因子(eIF4E/EIF4G複合体)を利用してタンパク質(ワクチン中のSARS-COV-2スパイクタンパク質)を合成します。
iii。 主要な分子メカニズムと最適化戦略
1。エンドソームエスケープ効率の向上
- 膜融合を改善するために、不飽和テールチェーン(e。g。、dlin-mc3-dma)の脂質を使用します。
- 膜の破壊を支援するために、pH感受性ペプチド(たとえば、ガラペプチド)を組み込みます。
2。免疫原性の低減
- 加速された血液クリアランス(ABC現象)を避けるために、ペギー化された脂質比を最適化します。
-LNPを精製して遊離mRNAを除去し、TLR7/8の活性化リスクを最小限に抑えます。
3。組織固有の送達
-LNP表面電荷を調整します(近神に近い ζ - ポテンシャル)肝細胞ターゲティング用。
-GALNACリガンドを使用してLNPを修正して、肝性アシアログリコタンパク質受容体(ASGPR)を標的とします。
IV。 技術的な課題と将来の方向性
課題:
- 肺、脳、およびその他の組織への低い送達効率。
- 繰り返し投与した潜在的な抗PEG抗体誘導。
進歩:
- 毒性を低下させるために、生分解性脂質(例えば、エステル修飾脂質)を発症します。
- 新しい脂質ライブラリの設計とLNP最適化のためにAIを活用します。
結論
LNPによるmRNAの膜貫通送達は、正確な物理化学的および細胞生物学的相互作用、特に動的な脂質膜調節に依存しています。 LNP技術はmRNAワクチンと遺伝子療法を臨床翻訳に推進していますが、送達精度と長期の安全性の継続的な最適化は依然として重要です。
参照
1。Hou、X。et al。 (2021)。 *ナット。 牧師。 *** 6 **、1078●1094.
2。Cullis、P。R.&Hope、M。J.(2017)。 *モル。 その後。 *** 25 **、1467●1475.