mRNAワクチンは最近、SARS-CoV-2に対して非常に効果的であることが証明されました。彼らの成功の鍵は脂質ベースのナノ粒子 (LNP) であり、効率的な mRNA 発現を可能にし、強力な抗体応答を促進するアジュバント特性をワクチンに付与します。効果的な癌ワクチンには、抗体応答ではなく、長寿命で定性的な CD8 T 細胞応答が必要です。全身ワクチン接種が最も効果的な経路のようですが、mRNA を抗原提示細胞に送達するには LNP 組成を適応させる必要があります。実験計画法を使用して、mRNA-LNP組成を調整し、1回の最適化ラウンド内で腫瘍特異的なCD8 T細胞応答を高レベルで達成しました。最適化された LNP 組成により、複数の脾臓免疫細胞集団による mRNA の取り込みが促進されました。I 型インターフェロンと食細胞は、T 細胞応答に不可欠であることがわかりました。驚いたことに、我々はまた、ワクチンによって誘発された CD8 T 細胞応答の刺激における B 細胞の役割がまだ特定されていないことも発見しました。最適化された LNP は、非ヒト霊長類で同様の脾臓中心の生体内分布プロファイルを示し、肝臓と脾臓の組織病理学的変化を引き起こさなかったため、臨床研究でさらに評価する必要があります。まとめると、我々の研究は、ナノ粒子組成とそのT細胞刺激能力との関係を明らかにし、効果的なmRNALNPベースの抗腫瘍免疫療法の根底にあるメカニズムへの新しい洞察を提供します. 最適化された LNP は、非ヒト霊長類で同様の脾臓中心の生体内分布プロファイルを示し、肝臓と脾臓の組織病理学的変化を引き起こさなかったため、臨床研究でさらに評価する必要があります。まとめると、我々の研究は、ナノ粒子組成とそのT細胞刺激能力との関係を明らかにし、効果的なmRNALNPベースの抗腫瘍免疫療法の根底にあるメカニズムへの新しい洞察を提供します. 最適化された LNP は、非ヒト霊長類で同様の脾臓中心の生体内分布プロファイルを示し、肝臓と脾臓の組織病理学的変化を引き起こさなかったため、臨床研究でさらに評価する必要があります。まとめると、我々の研究は、ナノ粒子組成とそのT細胞刺激能力との関係を明らかにし、効果的なmRNALNPベースの抗腫瘍免疫療法の根底にあるメカニズムへの新しい洞察を提供します.
序章
メッセンジャー RNA (mRNA) ワクチンは、目的の抗原をエンコードするように mRNA 配列を簡単に調整できるため、非常に用途が広く、新興病原体に対する迅速かつ大規模なワクチン開発と、癌に対する個別化されたワクチン設計の両方を可能にします。現在承認されている SARS-CoV2 mRNA ワクチンおよび臨床開発中の多くの mRNA ベースの予防ワクチンの成功の鍵は、脂質ベースのナノ粒子 (LNP) であり、in situ で効率的な mRNA 発現を媒介し、ワクチンに固有のアジュバント特性を付与する送達媒体です。 .
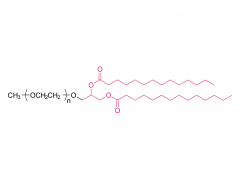
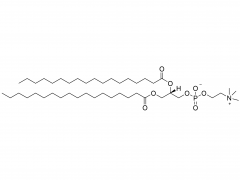
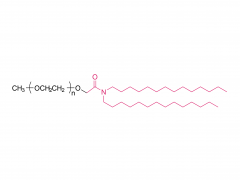
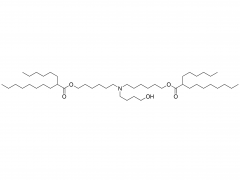
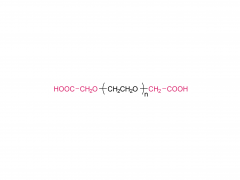
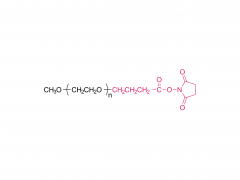
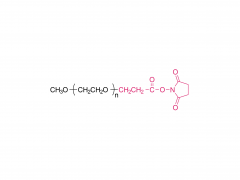
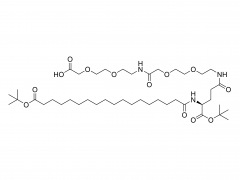
LNP は、イオン性脂質、リン脂質、コレステロール、および PEG 化脂質で構成されており、イオン性脂質は mRNA 発現の最も重要なドライバーと考えられています。さまざまな pH 範囲にわたって陽イオン電荷を持つそれらの前任者とは対照的に、イオン性脂質は、生理的 pH で中性電荷を持ちながら、エンドソーム pH で正の膜融合促進電荷を LNPs に付与する pH 感受性脂質です。イオン性脂質は、mRNA をカプセル化するために必要であり、エンドソームの脱出を促進します。ペグ化脂質は、LNP の安定性を改善し、相互作用を制御します。
血液タンパク質と細胞を含むLNP。コレステロールとリン脂質は、LNP の安定性とエンドソーム膜の不安定化に寄与します。
mRNA LNPの筋肉内または皮下投与は、mRNAがコードする抗原に対するCD8 T細胞応答を誘発することが報告されています。これらの戦略では、mRNA は局所抗原提示細胞 (APC) に送達され、循環中の抗原特異的 CD8 T 細胞レベルが低から中程度になります。ただし、効果的に (特に離れた場所で) 腫瘍と闘うには、強力で長期にわたる全身性の CD8 T 細胞応答が必要です。mRNAワクチンの静脈内(iv)送達は、脾臓に存在するAPCの大きなプールを動員する能力に関連している可能性が高く、T細胞応答と抗腫瘍免疫を強化することが記載されています。強力な CD8 T 細胞応答の誘導は、1、2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン (DOPE) およびカチオン性脂質 DOTMA を使用していますが、LNP ベースの製剤はまだ臨床で静脈内治療癌ワクチン接種に使用されていません。LNPは、細胞をトランスフェクトする固有の可能性が高いため、リポプレックスと比較してさらに改善された活性を示す可能性があります。それにもかかわらず、標準的な LNP 製剤は通常、CD8 T 細胞を刺激するために必要な APC の代わりに、静脈内送達時に肝細胞に RNA を送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。しかし、LNPベースの製剤は、臨床でがんのiv治療ワクチン接種にまだ使用されていません。LNPは、細胞をトランスフェクトする固有の可能性が高いため、リポプレックスと比較してさらに改善された活性を示す可能性があります。それにもかかわらず、標準的な LNP 製剤は通常、CD8 T 細胞を刺激するために必要な APC の代わりに、静脈内送達時に肝細胞に RNA を送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。しかし、LNPベースの製剤は、臨床でがんのiv治療ワクチン接種にまだ使用されていません。LNPは、細胞をトランスフェクトする固有の可能性が高いため、リポプレックスと比較してさらに改善された活性を示す可能性があります。それにもかかわらず、標準的な LNP 製剤は通常、CD8 T 細胞を刺激するために必要な APC の代わりに、静脈内送達時に肝細胞に RNA を送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。LNPは、細胞をトランスフェクトする固有の可能性が高いため、リポプレックスと比較してさらに改善された活性を示す可能性があります。それにもかかわらず、標準的な LNP 製剤は通常、CD8 T 細胞を刺激するために必要な APC の代わりに、静脈内送達時に肝細胞に RNA を送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。LNPは、細胞をトランスフェクトする固有の可能性が高いため、リポプレックスと比較してさらに改善された活性を示す可能性があります。それにもかかわらず、標準的な LNP 製剤は通常、CD8 T 細胞を刺激するために必要な APC の代わりに、静脈内送達時に肝細胞に RNA を送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。標準的な LNP 製剤は、通常、CD8 T 細胞を誘発するために必要な APC の代わりに、静脈内送達時に RNA を肝細胞に送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。標準的な LNP 製剤は、通常、CD8 T 細胞を誘発するために必要な APC の代わりに、静脈内送達時に RNA を肝細胞に送達します。この研究では、4つの脂質間のモル比の最適化と適切なポリエチレングリコール(PEG)脂質の選択により、LNPを全身ワクチン接種に合わせて調整できると推測しました。これらのパラメーターは、サイズ、z ポテンシャル、薬物動態、体内分布などの LNP 機能に影響を与えることが知られており、最終的に in vivo 免疫原性を決定します。
事実上無限の種類の潜在的な LNP 組成物を時間と費用対効果の高い方法で設計およびスクリーニングするために、ベイジアン回帰モデリングと組み合わせた統計的実験計画法 (DOE) に基づく設計による品質アプローチを採用しました。この戦略により、免疫原性を決定する重要な組成パラメーターを特定し、1 回の in vivo 免疫原性評価で最適な LNP 組成を予測することができました。最適な LNP 組成
(デザインスペースの制約内で)強力なCD8 T細胞応答が得られ、これは反復投与によって増強され、同系マウスTC-1腫瘍モデルで抗腫瘍効果を伝えました。メカニズムの研究により、T 細胞応答は、脾臓におけるさまざまな APC による最初の mRNA 発現と、I 型インターフェロン (IFN) の誘導に依存していることが明らかになりました。驚くべきことに、静脈内 mRNA-LNP ワクチン接種時の抗原特異的 CD8 T 細胞応答の誘発における B 細胞のこれまで認識されていなかった役割も発見しました。
Bevers ら、mRNA-LNP ワクチンは全身免疫のために調整され、脾臓免疫細胞に関与することにより強力な抗腫瘍免疫を誘導する、Molecular Therapy (2022)、https://doi.org/10.1016/j.ymthe.2022.07.007