脂質ナノ粒子(LNP)は、今日最も成功しているナノデリバリーキャリアの一つであり、細胞傷害性化学療法薬、抗生物質、核酸医薬品の送達において卓越した能力を発揮しています。LNPの中核成分であるPEG化脂質の構造選択は、製剤の安全性、安定性、および免疫原性に決定的な影響を与えます。
LNP製剤中のPEGによって引き起こされる免疫反応に悩まされたことはありませんか?既存の抗PEG抗体は、mRNA医薬品の臨床応用において避けられない課題となっています。今日、ヒドロキシル末端を有するPEG脂質(HO-PEG)は、新世代LNPの「透明マント」として注目されており、免疫認識を大幅に低減し、送達効率を向上させます。SINOPEGは、 HO-PEG脂質 既存の抗PEG抗体に対処するための独立した知的財産権を有します。
SINOPEG:国内HO-PEG脂質のリーダー
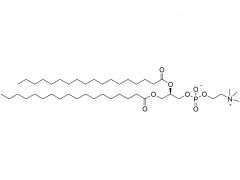
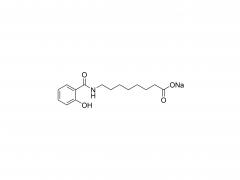
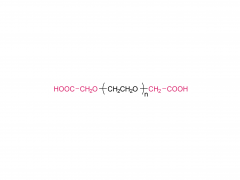
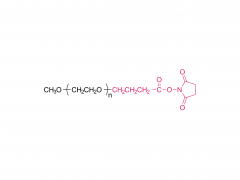
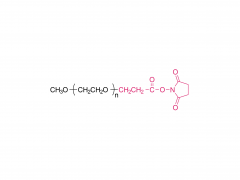
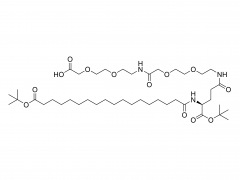
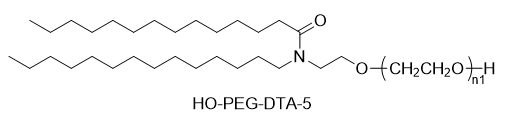
シノペグ は、常に新技術・新製品の研究開発に注力してきました。近年、様々な新しい脂質構造が市販されており、特に独自に開発したヒドロキシル末端を有するPEG脂質であるDTA-5(特許番号:ZL202280003648.7)は注目に値します。HO-PEG-DTA-5は、中国、米国、欧州を含む主要市場をカバーする包括的なグローバル知的財産ポートフォリオを確立しています。さらに、この脂質は、中国と米国の両方でドラッグマスターファイル(DMF)の申請を完了間近です。その構造は以下のとおりです。
HO-PEG 脂質: 次世代 LNP としてなぜ選ばれるのか?
近年、ヒドロキシル末端を有するPEG脂質(HO-PEG)は、免疫原性の低減と既存の抗PEG抗体による認識回避という大きな利点から、次世代LNP開発において徐々に注目を集めています。mRNA治療の世界的リーダーであるModerna社は、数多くの前臨床および臨床製剤において、この脂質を広く使用しており、その可能性をさらに検証しています。
モデナ社は先日、ネイチャー・コミュニケーションズ誌に「プロピオン酸血症、メチルマロン酸血症、およびフェニルケトン尿症の治療におけるmRNA治療薬の作用機序の解明」と題する重要な研究論文を発表しました。この論文では、代謝性疾患(プロピオン酸血症(PA)、メチルマロン酸血症(MMA)、フェニルケトン尿症(PKU)を含む)の治療を目的とした3つのmRNA治療薬(mRNA-3927(PAの治験薬)、mRNA-3705(MMAの治験薬)、およびmRNA-3210(PKUの治験薬))の作用機序を体系的に解明しています。これら3つのmRNA治療薬はすべてLNP送達システムを採用しており、マウスモデルにおいて、標的mRNAの発現、タンパク質活性の上昇、関連代謝物の減少など、良好な薬物動態/薬力学(PK/PD)反応を示しました。
本研究におけるこれら 3 つの治療法では、統一された LNP 製剤が採用されており、カチオン性脂質は SM-86、PEG 脂質は OL-56 でした。
SM-86は、SPIKEVAX®の過去の非臨床レビュー報告書に記載されています。SM-102と構造的に類似した脂質であり、ラットを用いた静脈内投与試験では、薬物動態、組織分布、排泄プロファイルもSM-102と類似していました。これは、モデナ社が以前に脂質送達キャリアに関する研究で言及した脂質5に相当します。
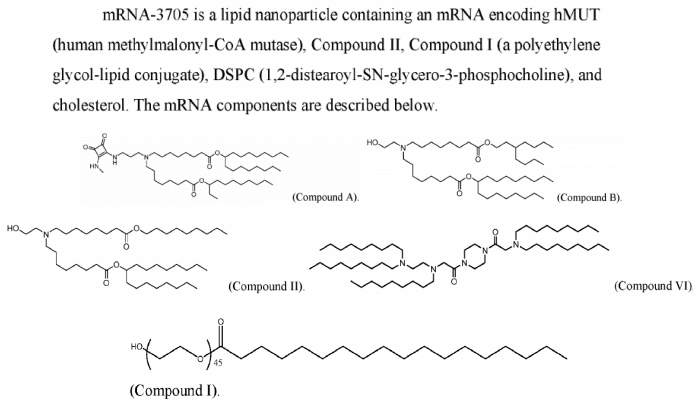
OL-56は、モデナ社が既に開示している特許情報に基づき、ポリエチレングリコール化脂肪酸誘導体(式(VI)構造に属する)として記載されており、PEGのヒドロキシル末端(-OH)を特徴とするHO-PEG脂質です。このタイプのPEG脂質は、複数の特許文献において様々なイオン化脂質(化合物A、B、II、VIなど)と組み合わせて使用されており、良好な適合性と送達効率が実証されています。特許WO2022246020A1はmRNA-3705の製剤を開示しており、特許で開示されている化合物Iが論文で言及されているOL-56であることが確認されています。
研究チームは、前臨床マウスモデルの薬物動態(PK)および薬力学(PD)データに基づき、各mRNA治療薬の前臨床PK/PDモデルを開発しました。これらのモデルは、モデルパラメータの相対成長スケーリングを用いてヒトへの投与量予測に効果的に適用されました。具体的には、プロピオン酸血症(PA)およびメチルマロン酸血症(MMA)の研究では、マウス、ラット、サルのデータを統合し、種間スケーリング法を用いてヒト初回投与量(FIH)を予測しました。フェニルケトン尿症(PKU)については、主に疾患関連モデルであるPAHenu2マウスモデルに基づいて予測を行いました。
下記の表1に示すように、PK/PDモデリングの結果に基づき、3つのmRNA治療薬(mRNA-3927、mRNA-3705、mRNA-3210)の推定FIH用量はそれぞれ0.3 mg/kg、0.1 mg/kg、0.4 mg/kgです。これらの値は、対応する無毒性量(NOAEL)であるPA 3 mg/kg、MMA 5 mg/kg、PKU 3 mg/kgを大幅に下回り、それぞれ10、50、7.5の安全マージンを達成しており、臨床安全性において優れた可能性を示しています。
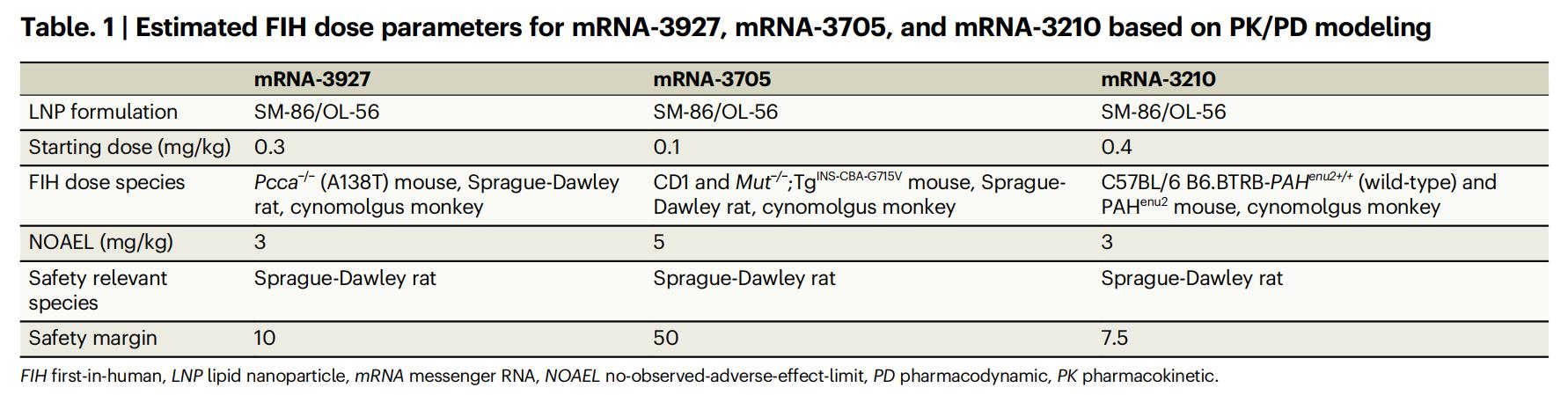
表1:PK/PDモデリングに基づくmRNA-3927、mRNA-3705、mRNA-3210の推定FIH用量パラメータ
最近、復旦大学基礎医学学院の詹昌有教授率いる研究チームは、プレプリント誌bioRxivにOH末端を有するPEG脂質に関する関連研究を発表しました。この研究では、ヒトにおける既存の抗PEG抗体による認識を回避する上で、ヒドロキシル末端(OH末端)を有するPEG脂質の画期的な可能性を体系的に探究しました。大規模多施設臨床血清の体系的なスクリーニングにより、広く普及している抗ポリエチレングリコール(抗PEG)抗体によるPEG物質の認識は、顕著な末端選択性を示すことが明らかになりました。中でも、ヒドロキシルPEG(HO-PEG)は、既存の抗PEG抗体との結合を著しく回避するという、優れた「免疫回避」能力を示しました。
本研究では、ELISA、等温滴定熱量測定(ITC)、および様々なin vitro機能アッセイを包括的に用い、異なる末端構造(MeO-、HO-、NH₂-、COOH-PEGなど)を持つPEG材料の抗体への結合特性を体系的に比較しました。下図の結果は、HO-PEGが全ての試験において最も低い免疫認識率を示し、陽性結合シグナルが90%以上減少したことを示しています。特に注目すべきは、種間比較において、ヒトの既存抗体は主にPEG末端構造を認識するのに対し、動物モデルで誘導された抗体はPEG繰り返し単位を標的とすることが多いことが明らかになったことです。この重要な違いは、HO-PEGの利点が非常に特異性が高く、臨床現場において大きな応用可能性を秘めていることを示唆しています。
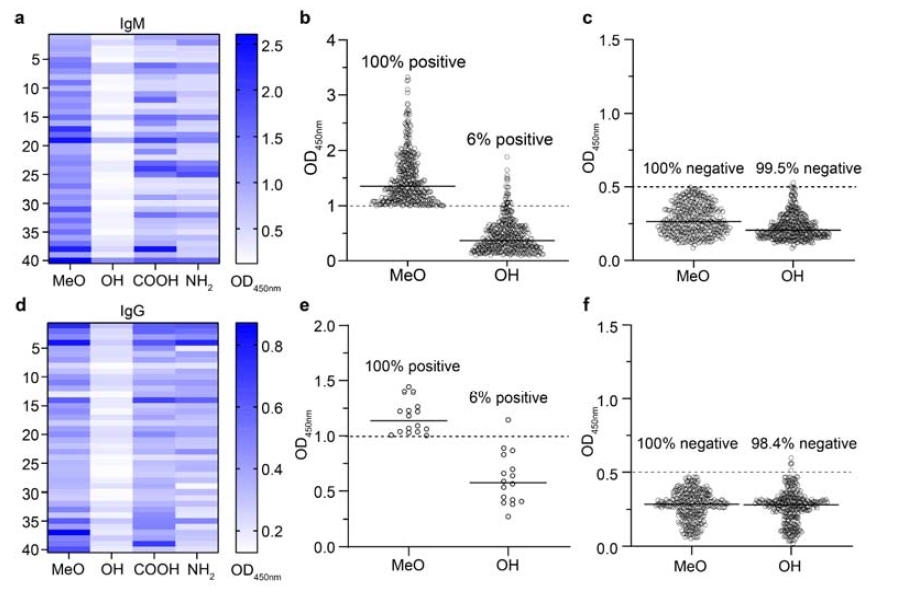
図:ヒト既存抗PEG抗体の末端選択性
要約すると、本研究では、従来のメトキシPEG(MeO-PEG)と比較して、HO-PEGで修飾された脂質ナノ粒子(LNP)は、補体活性化レベルを大幅に低下させ、アナフィラトキシン産生を減少させ、LNPの血漿安定性を著しく向上させ、抗体陽性ヒト血清における非標的マクロファージへの取り込みを減少させることが実証されました。これらの改良は、LNPベースの薬剤の送達効率とin vivo性能を向上させ、臨床的な免疫関連副作用を低減するための実用的な新材料戦略を提供します。
モデナ社と復旦大学の両研究は、ヒドロキシル末端を有するPEG脂質が、製剤の安全性向上と免疫反応の抑制における重要な賦形剤として重要な価値を持つことを裏付けています。このような高度な機能性脂質材料の採用は、次世代核酸医薬品送達システムの開発において重要な方向性となりつつあります。
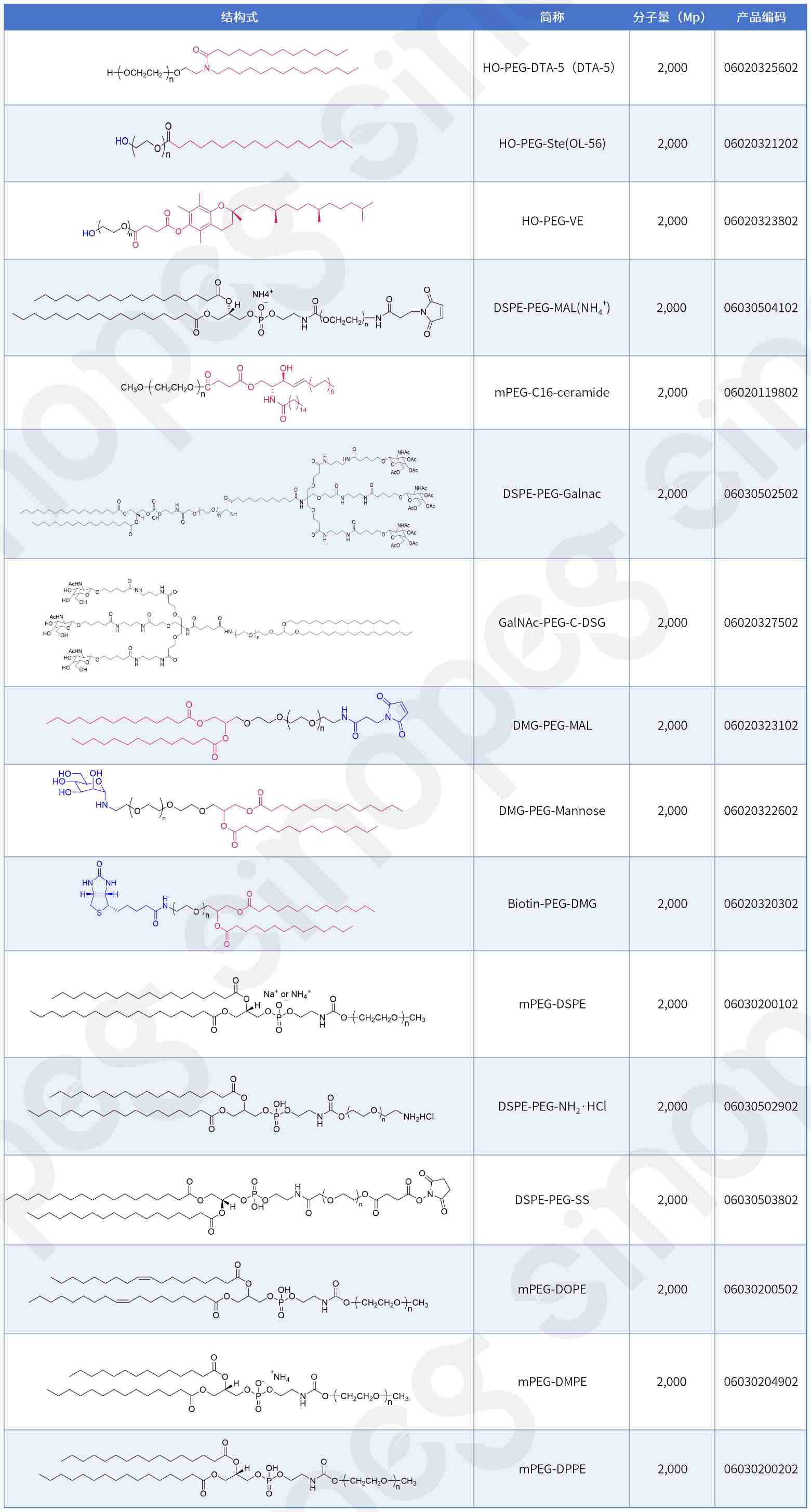
SINOPEG は、HO-PEG 脂質だけでなく、DSPE-PEG-MAL、GaINAC-PEG-C-DSG、OL-56 (HO-PEG-Ste)、mPEG-C16-セラミド、mPEG-DHE-、ビオチン-PEG-DMG、DMG-PEG-MAL、HO-PEG-VE、DMG-PEG-マンノース、DSPE-PEG-Galnac、mPEG-DPPE (14:0 PEG2000)、mPEG-DMPE (16:0 PEG2000 PE-2K)、mPEG-DOPE (18:1 PEG2000 PE-2K) などの新しい PEG 脂質構造も提供しています。